Identification des signaux chimiques impliqués dans la reconnaissance et l'acceptation des larves de l'hôte par C. typhae
Les parasitoïdes en quête d’un hôte pour y pondre se repèrent grâce aux odeurs qu’il émet et à celles de son habitat. Lorsque différents hôtes sont présents dans la même plante ou le même champ, la perception de substances volatiles spécifiques et de substances détectées au contact émises par l'hôte lui-même permet aux parasitoïdes à la fois de différencier les hôtes des non-hôtes et d'estimer l'état de santé de son hôte. Ainsi, les sécrétions buccales de l'hôte en train de se nourrir, perçues par contact, peuvent jouer un rôle clé dans cette évaluation.
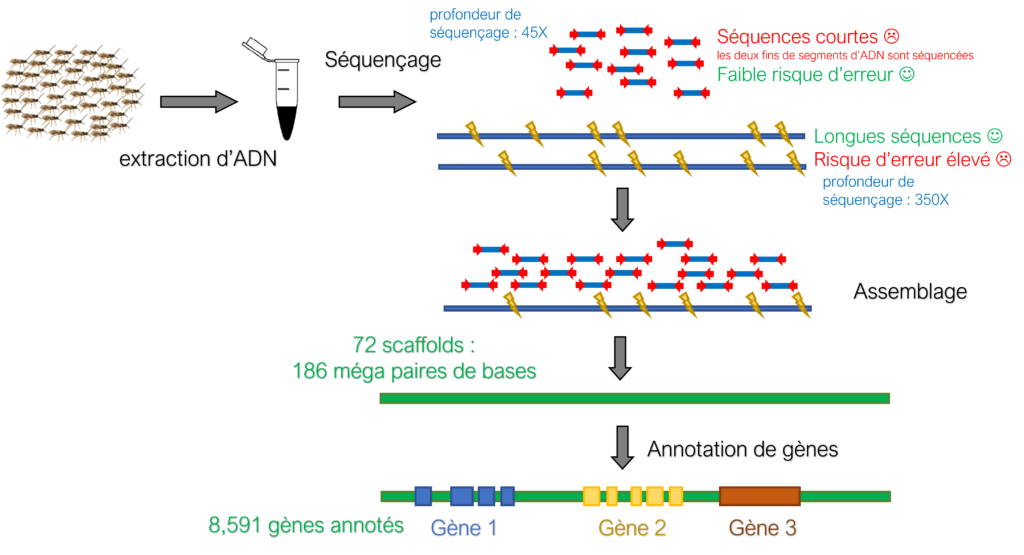
Des observations comportementales et des approches biochimiques ont révélé que les parasitoïdes femelles du complexe d'espèces Cotesia flavipes, dont C. typhae, reconnaissent leurs espèces hôtes respectives et y pondent en réaction à une α-amylase, une enzyme digestive présente dans les sécrétions buccales des larves hôtes (Bichanga et al. 2018a, 2018b). Il a en outre été démontré que c'est la conformation de l'enzyme qui est responsable de l’acceptation de l’hôte pour y pondre, et non la séquence de son site catalytique ou encore la nature du substrat nutritif de l’hôte ou celle de ses produits de dégradation.
Legend :
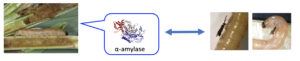
- Larve de lépidoptère foreur de tiges trouvée dans sa galerie remplie d'excréments.
- Enzyme digestive contenue dans la sécrétion buccale de larves en train de se nourrir. L‘enzyme est présente dans les excréments des larves et sur le corps de l’hôte.
- Extrait d’excréments déposé sur du coton (gauche). Le même comportement est observé en présence d’une solution d’α-amylase ; lorsque déposée sur le corps lavé de l’hôte, celle-ci réactive l’acceptation de l’hôte pour la ponte (droite).
Fertilité des Cotesia mâles et femelles et comportements reproducteurs
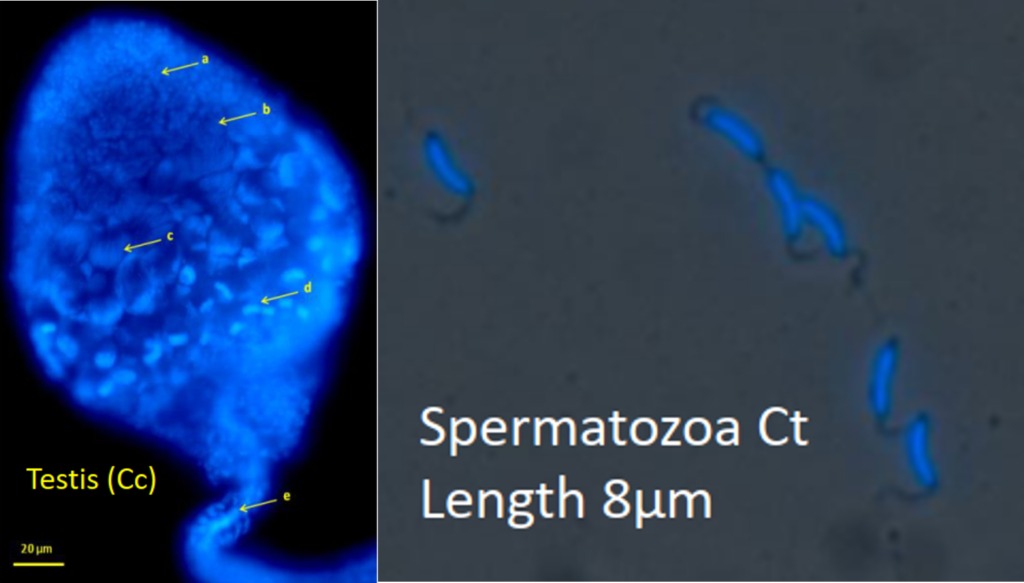
La connaissance du potentiel reproducteur des insectes parasitoïdes est indispensable en biocontrôle pour ajuster le nombre d'insectes introduits à la taille de la population du ravageur. Ce potentiel dépend du nombre d'ovocytes et de spermatozoïdes matures (fertilité initiale) et du comportement reproducteur. Les femelles de C. typhae sont pro-ovogèniques, ce qui signifie que la plupart des œufs sont matures dès leur éclosion ou peu après. Une femelle produit environ 200 ovocytes (Benoist et al. 2020).
Les spermatozoïdes des mâles sont également matures lorsqu'ils émergent, mais la spermatogenèse se poursuit pendant quelques jours après leur éclosion. Le pic est atteint au bout de trois jours, avec environ 22000 spermatozoïdes.
Les adultes s'accouplent dès leur éclosion et peuvent se ré-accoupler au cours de leur courte vie. Chez les insectes, après la copulation, les spermatozoïdes sont stockés dans un réservoir femelle appelé la spermathèque. La fécondation des ovocytes a lieu dans l'oviducte où s'ouvre la spermathèque. Comme la plupart des Hyménoptères, C. typhae est haplo-diploïde, ce qui signifie que les œufs non fécondés (haploïdes) donneront des mâles, et les œufs fécondés (diploïdes) des femelles. Lorsque l'accouplement est réussi, la progéniture contient un mélange de mâles et de femelles dans des proportions de genres variables. Les femelles non fécondées donneront naissance à des fils presque exclusivement (mais voir Capdevielle et al., 2022) .


Virulence et résistance : mécanismes tissulaires et moléculaires
Comment cela marche ?
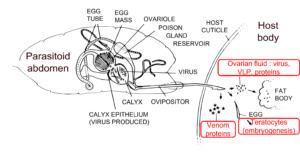
Les endoparasitoïdes doivent déjouer les défenses immunitaires de leur hôte pour se développer avec succès. En effet, le système immunitaire des arthropodes est capable de détecter la présence de corps étrangers dans l'hémolymphe (le « sang » de l'insecte), et de procéder à leur destruction, soit par phagocytose (pour les pathogènes ou parasites microscopiques), soit par encapsulation (pour les corps plus gros, comme les œufs de parasitoïdes). Ce processus s'accompagne généralement de la production de plusieurs molécules de défense, telles que des composés antiviraux, antibactériens ou cytotoxiques (l'une d'entre elles étant la mélanine, la molécule noire caractéristique souvent observée sur les arthropodes blessés). Ce phénomène est appelé « résistance de l'hôte ».
Pour éviter ces réactions défensives, le parasitoïde va manipuler ou même carrément annihiler la réponse immunitaire de l'hôte, cette capacité est appelée « virulence ». Pour ce faire, il peut injecter avec ses œufs plusieurs composants qui permettront le développement interne ovo-larvaire. Il s'agit des protéines du venin (fabriquées dans la glande à venin), des protéines ovariennes, des virus endosymbiotiques (virus domestiqué intégré dans l'ADN du parasitoïde) ou des Virus-Like Particles (VLP), tous produits dans les ovaires, et dans certains cas, des tératocytes, qui sont des cellules fabriquées pendant l'embryogenèse et qui peuvent exprimer des facteurs de virulence.
Variations de virulence chez Cotesia typhae et de résistance chez son hôte
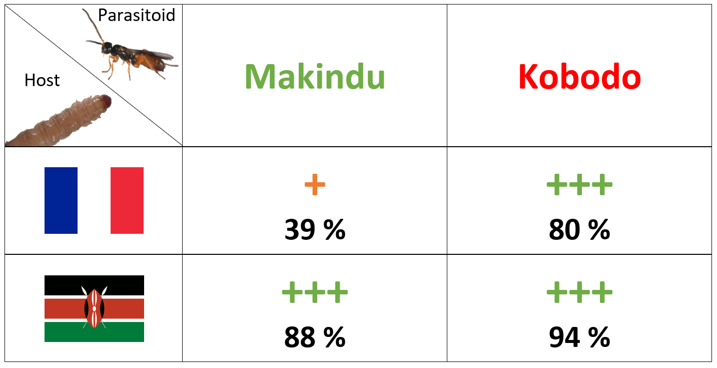
Les souches kenyanes de Cotesia typhae collectées sur deux sites (Kobodo et Makindu) diffèrent dans leur succès de parasitisme lors de la ponte d'œufs dans des larves de Sesamia nonagrioides provenant d'une population française. En effet, alors que les deux souches obtiennent un bon succès de parasitisme chez l'hôte kenyan, le succès de Makindu diminue de moitié chez l'hôte français, alors que celui de Kobodo reste élevé.
Cet hôte est donc plus résistant (SnR+) puisqu’il peut contrer le parasitisme d’une souche moins virulente (Makindu, CtV-), bien qu’étant toujours sensible à la souche la plus virulente (Kobodo, CtV+). Notre projet vise à déterminer quels sont les éléments physiologiques et génétiques du succès du parasitisme dans cette interaction. La virulence est en partie déterminée génétiquement (Benoist et al. 2017) et quelques segments d'ADN sont impliqués dans ce comportement (Benoist et al. 2020). Ils portent des centaines de gènes candidats.
Pour étudier plus en détail la virulence du parasitoïde, nous avons caractérisé la résistance des hôtes SnR+ face à la souche CtV-, puis identifié et quantifié l’expression des gènes proviraux (portés par le virus endosymbionte) et des gènes de venin potentiellement responsables de la différence de parasitisme entre les souches. Enfin, nous recherché les effets physiologiques des deux principaux facteurs de virulence dans le genre Cotesia, le venin et le fluide ovarien.
Mécanismes mis en évidence
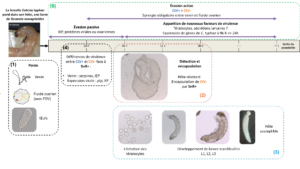
(1) Quand il parasite une chenille, le parasitoïde injecte avec ses œufs du venin et un fluide ovarien contenant les particules virales.
(2) Quand le parasitoïde peu virulent (CtV-) pond dans l’hôte plus résistant (SNR+), ses œufs commencent à être encapsulés 48 heures après et le sont complètement au bout de 96 heures.
(3) Par contre ils ne le sont pas dans les autres interactions (CtV-/SnR-, CtV+/SnR-, CtV+/SnR+), où ils éclosent, les larves se développent normalement, et sortent de la chenille au bout de 11 jours (Gornard et al., 2024a).
(4) La composition du venin, révélée par une approche de protéomique (caractérisation de tous les peptides et protéines du venin), diffère quantitativement entre les souches du parasitoïde. Notamment, le venin de CtV+ contient plus de serpines, impliquées dans l’abolition du système immunitaire, tandis que celui de CtV- est plus riche en ImmunoEvasive Proteins, potentiellement impliquées dans le camouflage des œufs (Gornard et al., 2024a et al., 2024b).
Avant l’encapsulation des œufs, 24h après la ponte, l’expression de certains gènes proviraux (quantifiée par transcriptomique) diffère aussi entre les souches du parasitoïde. Parmi eux se trouvent des gènes situés dans un QTL associé au plus faible succès parasitaire de CtV-, et encodant des protéines (ptp, EP) connues pour leur implication dans la virulence d’espèces du genre Cotesia (Gornard et al., 2024b).
(5) Enfin, des expériences d’injection des facteurs de virulence (venin et/ou fluide ovarien, encadré 1) ont révélé une synergie obligatoire entre le venin et le fluide ovarien pour permettre le succès parasitaire, synergie qui ferait donc défaut lorsque la souche CtV- tente de parasiter l’hôte SnR+. Cela confirme ce mécanisme montré chez d’autres espèces du genre Cotesia (Gornard et al., 2025).
Ensemble, ces approches montrent que l’évitement des défenses immunitaires de l’hôte par C. typhae repose sur la co-existence de deux stratégies. L’évasion passive où les œufs sont dans un premier temps dissimulés par un camouflage moléculaire (le système immunitaire de l’hôte restant compétent) et l’évasion active (potentiellement à la suite de l’évasion passive) où les facteurs de virulence entrent en jeu pour contrer le système immunitaire. Une différence d’importance relative de ces deux stratégies expliquerait les variations de virulence entre populations de C.typhae
Virulence et résistance : comment le bracovirus symbiotique de Cotesia interagit avec le génome de l’hôte ?
Les bracovirus (BV) sont des virus domestiqués présents dans les génomes de certaines familles de parasites Braconidae. Ils sont composés de gènes domestiqués d'un nudivirus, codant des particules virales dans lesquelles sont empaquetés les cercles d'ADN des parasitoïdes. Au cours du parasitisme, les Braconidae, dont C. typhae, injectent ces BV dans leurs hôtes lors de la ponte des œufs. Les cellules hôtes infectées produisent des protéines virales qui inhibent la réponse immunitaire de l'hôte contre les œufs de parasitoïdes. 27 segments d'ADN proviraux ont été annotés dans le génome de C. typhae, et il a été démontré que 16 des cercles d'ADN résultants s'intègrent massivement dans les chromosomes de divers tissus somatiques de l'hôte (Muller et. Al. 2021).
Chez les Sesamia nonagrioides survivant au parasitisme, les intégrations chromosomiques de BV persistent jusqu'au stade adulte. Cependant, la transmission de ces BV intégrés à la descendance n'a pas encore été observée, ce qui indique soit que les gamètes hôtes sont moins ciblés par les BV que les cellules somatiques, soit que les gamètes intégrant des BV sont non fonctionnels. (Muller et al. 2022).
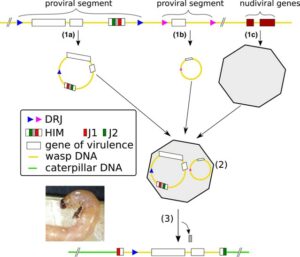
Structure de bracovirus. Dans le génome du parasitoïde, (1a) représente un segment contenant un Host-Integration-Motif (HIM), (1b) un segment dépourvu de HIM et (1c) un segment avec des gènes d'origine virale. Les rectangles blancs représentent les gènes de virulence. Dans le calice de la guêpe, (1a) et (1b) forment des cercles d'ADN grâce à leurs jonctions directes répétées (DRJ), tandis que (1c) forme des particules virales. Les cercles d'ADN sont renfermés dans les particules virales (2), qui sont injectées dans la chenille hôte en même temps que les œufs de la guêpe. Dans les cellules hôtes infectées par les particules, les segments contenant un HIM peuvent s'intégrer dans les chromosomes (3), et les locus HIM appelés J1 et J2 délimitent l'intégration, permettant de révéler l’intégration lors du séquençage du génome de l'hôte. Muller et al. 2022
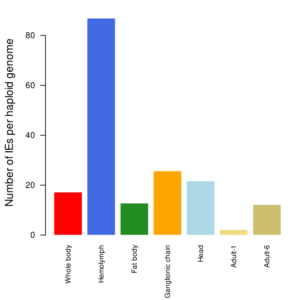
Occurrence estimée d’évènements d’intégration de “BV ” (IEs) par génome haploïde de S. nonagrioides.
Les 5 premiers échantillons d’ADN ont été extraits de tissus larvaires 7 jours après le parasitisme (Muller et al. JVI 2021), tandis que les deux derniers échantillons ont été extraits des corps entiers des deux adultes survivants (Muller et al. 2022).
Virulence et résistance : recherche des gènes de virulence par une approche de génétique quantitative
Une expérience croisée a été menée pour identifier les facteurs génétiques expliquant la différence de succès reproductif entre les deux souches de Cotesia typhae Kobodo et Makindu. La progéniture des femelles hybrides a été caractérisée phénotypiquement pour :
1) leur capacité à parasiter avec succès une population française de Sesamia nonagrioides,
2) le nombre de descendants produits par chaque femelle et
3) le ratio mâles/femelles parmi les descendants.
La même progéniture a également été analysée génétiquement à l'aide de marqueurs moléculaires différant entre les deux souches. Grâce à ces données génétiques, les marqueurs ont été disposés le long des dix chromosomes de C. typhae pour élaborer une carte génétique. Cette approche permet d'identifier les régions chromosomiques impliquées dans la variation quantitative, dites Quantitative Trait Loci (QTL). Pour les deux premiers traits, quatre QTL ont été décrits, l'un d'entre eux étant lié à la fois au succès du parasitisme et au nombre de descendants (Benoist et al. 2020).
Les marqueurs moléculaires ont été localisés dans le génome de référence de Cotesia typhae afin de répertorier les gènes annotés dans chaque région QTL. Les gènes présentant un intérêt spécifique ont été identifiés, tels que les gènes du venin et les gènes des segments proviraux ou nudiviraux du bracovirus.
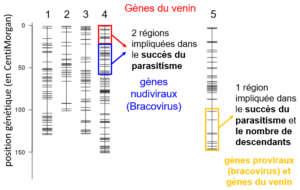
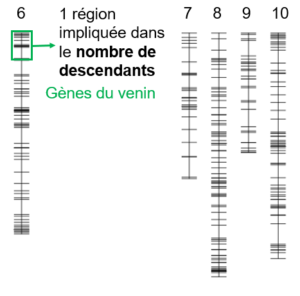
QTL impliqués dans le succès reproductif. Chaque barre verticale représente un chromosome de Cotesia typhae et chaque segment horizontal est un marqueur moléculaire. Les quatre QTL identifiés sont les cases de couleur. Les gènes intéressants identifiés dans chaque région QTL sont mentionnés.
Le déterminisme du sexe chez C. typhae
Les hyménoptères sont des organismes haplodiploïdes : les femelles sont diploïdes et les mâles haploïdes. On considère la reproduction arrhénotoque comme mode de reproduction ancestral chez les hyménoptères. Dans ce système, les femelles sont produites sexuellement et les mâles sont produits par parthénogenèse. Cotesia typhae utilise ce mode de reproduction, c’est-à-dire que les femelles fécondées engendrent une progéniture mixte tandis que les femelles non fécondées donnent naissance uniquement à des mâles.
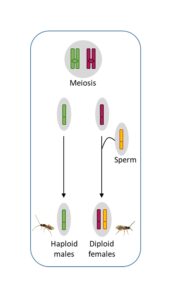
Cependant nous avons découvert en laboratoire que les femelles non fécondées produisaient parfois un petit nombre de femelles parmi une majorité de mâles. La production de femelles par parthénogenèse est appelée la thélytoquie. Nous avons remarqué que ce phénomène se produit dans les souches de laboratoire comme dans les populations sauvages, et confirmons que les femelles produites par parthénogenèse sont viables et fertiles. En utilisant des marqueurs génétiques, nous avons également découvert que, bien que les filles engendrées par des femelles fécondées soient pour la plupart produites sexuellement, il y a une faible proportion de filles produites par parthénogenèse. (Capdevielle Dulac et al, 2022).
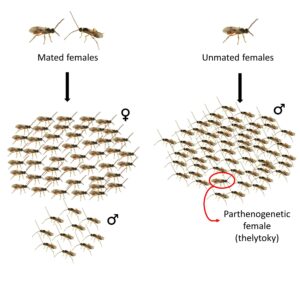
La thélytoquie peut se réaliser soit par un processus génétique, soit grâce à la présence d’une bactérie spécifique. Alors que la thélytoquie a été constatée chez de nombreuses espèces, il est rare de l’observer à faible fréquence comme chez Cotesia typhae. En général, les populations sont soit complètement arrhénotoques soit complètement thélytoques.
La reproduction sexuée confère une plus grande capacité d'adaptation grâce à la recombinaison et à la diversité qui lui est associée. D’un autre point de vue, la parthénogenèse peut être avantageuse dans des environnements stables car elle requiert moins d’énergie. Ce pourrait être intéressant de savoir si la faible fréquence de la thélytoquie observée chez Cotesia typhae est stable ou transitoire, car cela pourrait nous aider à comprendre comment les autres espèces évoluent entre reproduction sexuée et parthénogenèse.