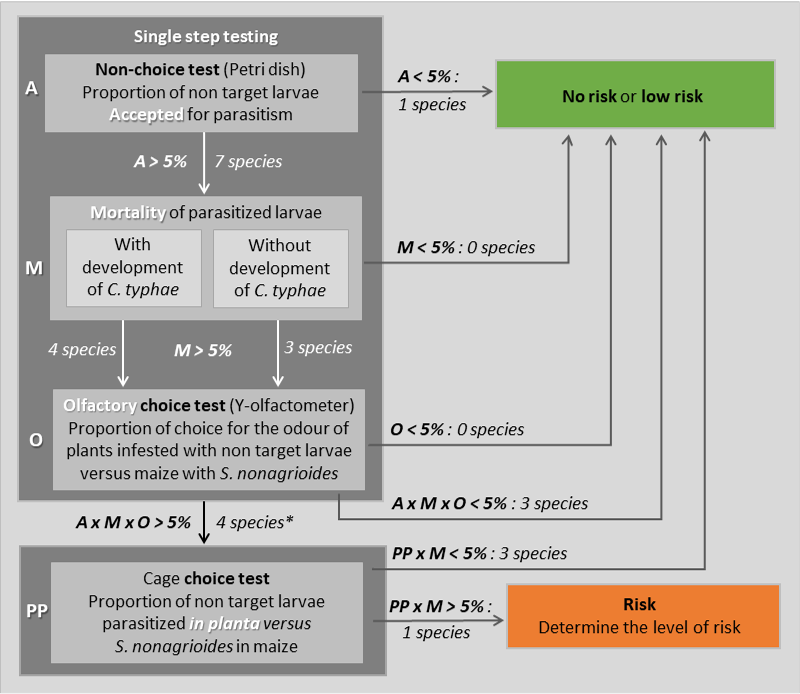
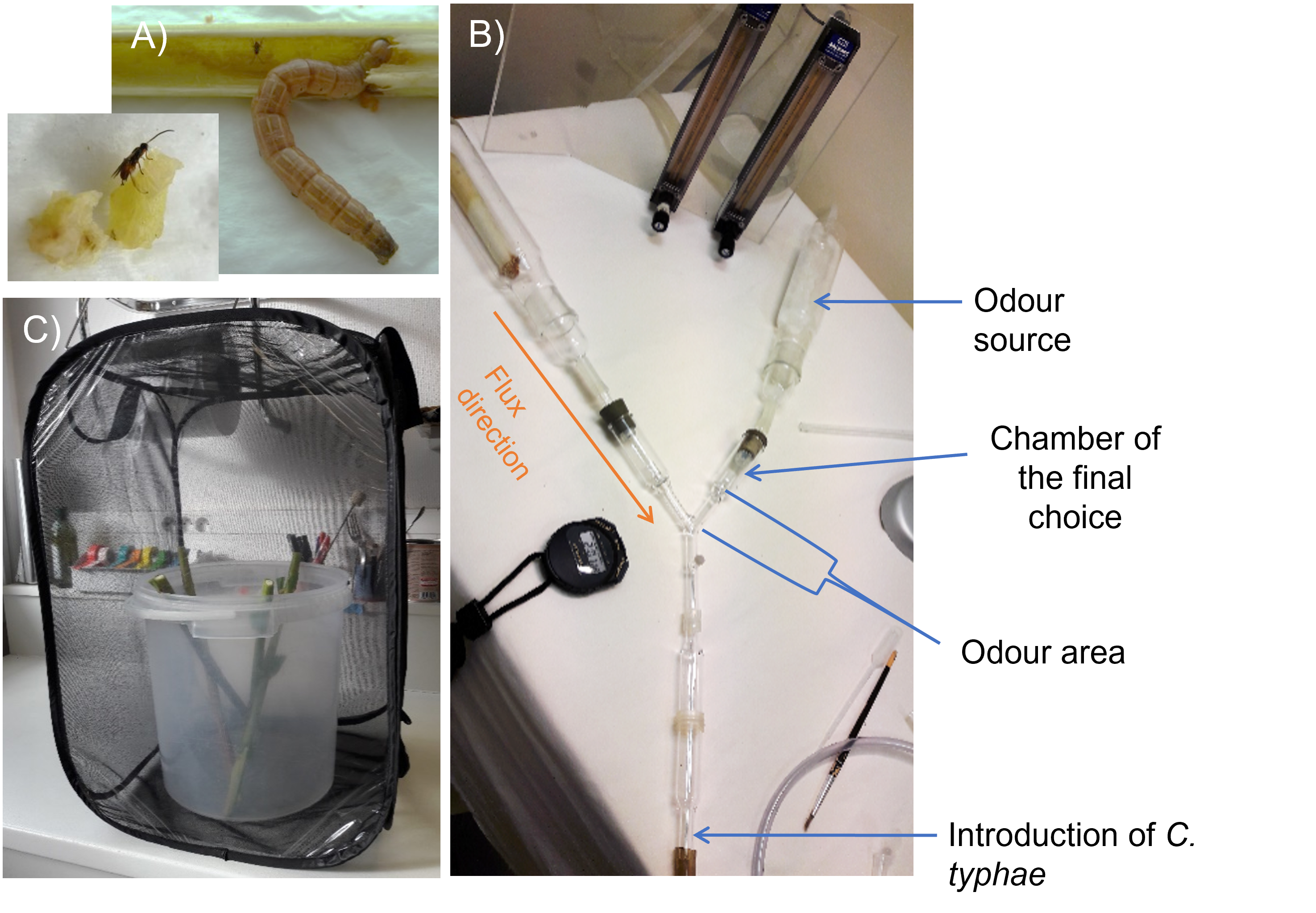
Risques environnementaux : évaluation du risque d’établissement
Le risque environnemental posé par l’introduction d’une espèce exotique va dépendre de sa capacité d’établissement à long terme. Cotesia typhae étant une espèce décrite uniquement en Afrique de l'Est (Kaiser et al. 2015), elle n'est pas habituée aux températures froides que l'on peut rencontrer en hiver en France. Par conséquent, son activité, son développement et sa survie à de basses températures pourraient représenter la principale barrière à son établissement à long terme en France. Ces connaissances ont été acquises en exposant les différents stades de l’insecte à des gammes de températures hivernales, sur différentes durées.
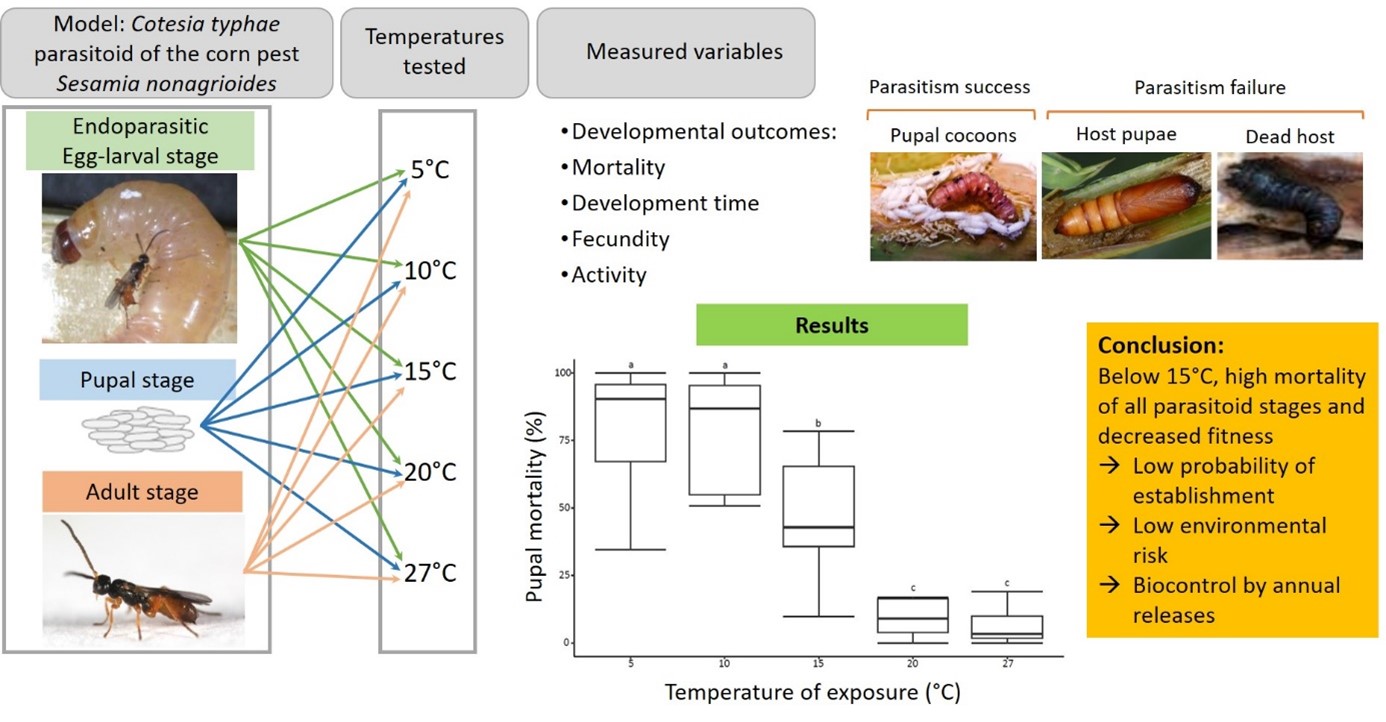
De plus l’exposition à des températures basses induisent des effets non létaux sur la fertilité des parasitoïdes. (Bressac et al. 2023)
L’ensemble des résultats concluent à une faible probabilité de survie hivernale puisque des températures inférieures à 15°C entraînent une forte mortalité à tous les stades de l’insecte. Considérant que deux semaines passées à 10°C ou moins en moyenne empêcheraient toute survie, il a été possible de calculer le pourcentage d’hivers non permissifs par département, entre 2000 et 2020 :
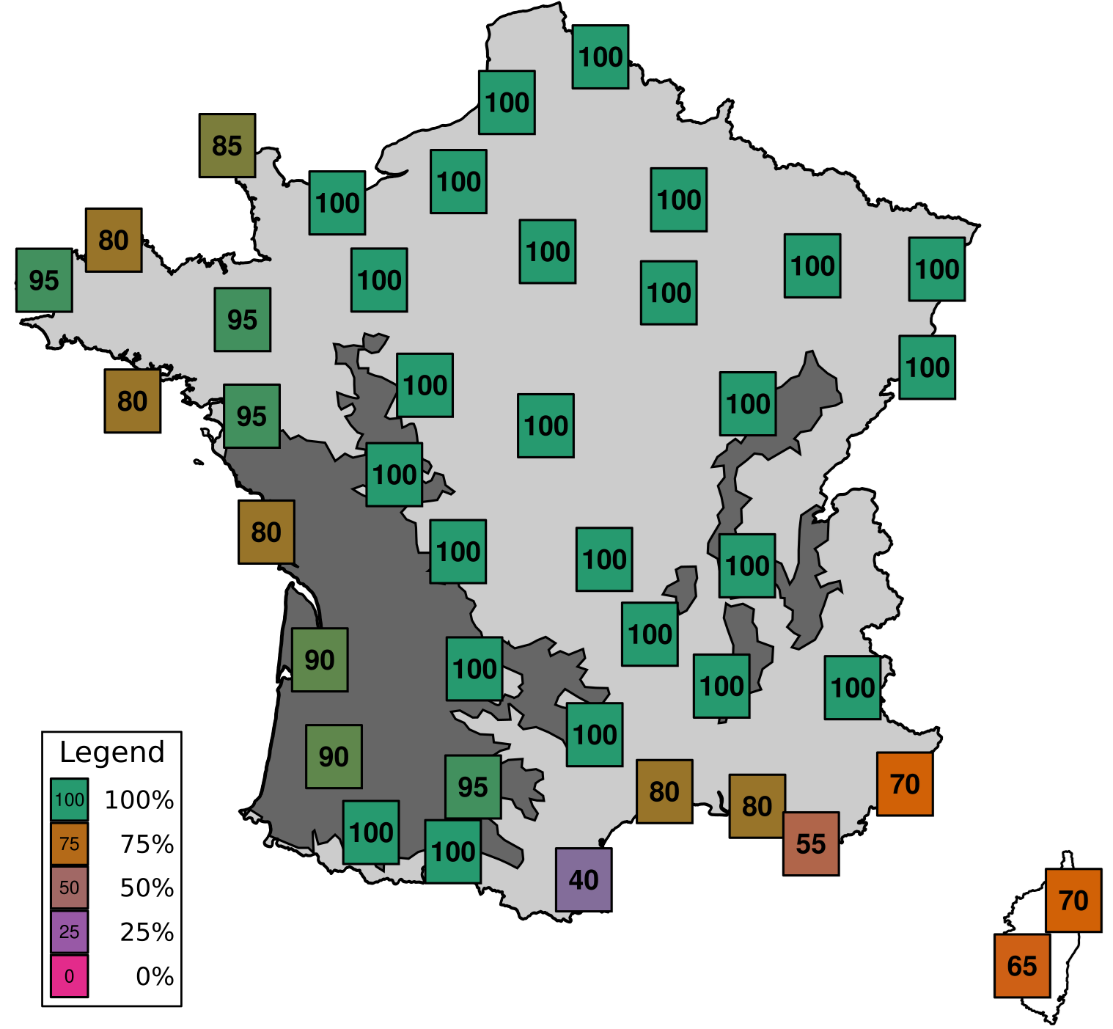
Les régions où la sésamie est un ravageur du maïs sont indiquées en gris foncé. Dans certains de ces départements le taux de survie hivernal de C. typhae ne serait donc pas nul et sera estimé suite aux lâchers aux champs prévus dans le cadre du projet Biocosma.
Efficacité parasitaire (sous serre)
Quatre expériences sous serre ont été menées pour tester l'efficacité des parasitoïdes. Les deux premiers essais proposaient d’estimer l'efficacité immédiate après le lâcher en fonction de la température et de la quantité de parasitoïdes. Les résultats ont montré que le parasitoïde était actif entre 15 et 25°C et que le taux de parasitisme variait en fonction du nombre de parasitoïdes relâchés. Un troisième et un quatrième essai ont été menés pour évaluer l'efficacité à long terme. Le troisième essai a montré qu'un lâcher du parasitoïde à plusieurs stades de développement permettait d'obtenir un taux de parasitisme stable de 58% en moyenne pendant 3,5 mois, période pendant laquelle une génération de S. nonagrioides s'est développée. L'amélioration du protocole pour le quatrième essai a permis une suppression presque totale du ravageur par C. typhae sur la même durée (1), et une amélioration significative de la santé des plantes (2). L'activité prolongée de C. typhae après un seul lâcher est très encourageante (Fortuna et al. Phloème 2022 ; Fortuna et al. CIRAA 2024 ; Gravé et al. Perspectives Agricoles, Juin 2024).
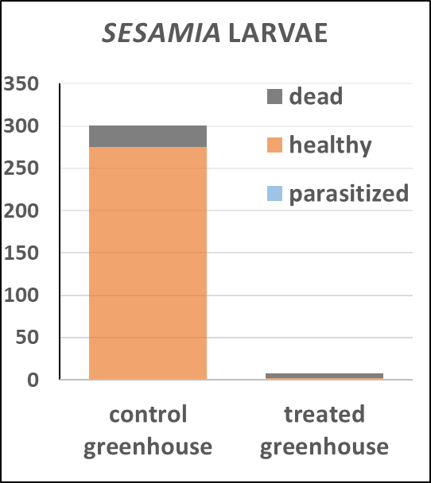
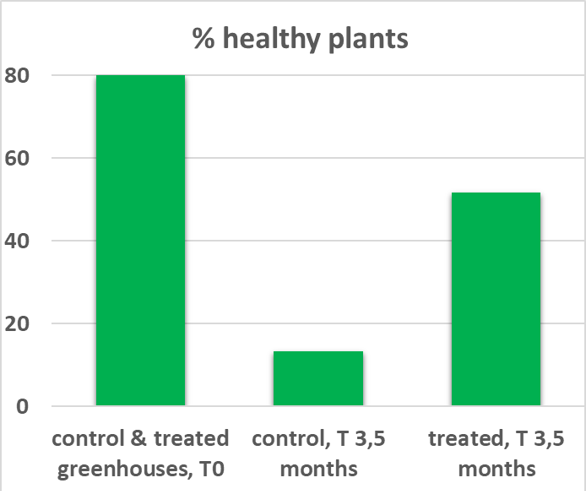
Méthodologie des essais sous serre






Production de parasitoïdes
L'objectif est de développer des méthodes d'élevage en masse de l'agent de contrôle biologique potentiel (et de son hôte) dans une perspective de production industrielle et de commercialisation. Les techniques disponibles à l'échelle du laboratoire pour l'élevage en continu de S. nonagrioides en milieu artificiel et de son parasitoïde C. typhae ont été utilisées comme point de départ (Giacometti, 1995 ; Poitout et al., 1972 ; Overholt et al., 1994).
Comme la demande sera saisonnière en France, l'objectif est de pouvoir passer d'une production de C. typhae d'environ 1000 femelles/semaine à 50 fois plus. En fait, 50000 femelles permettraient de traiter cinquante hectares de maïs en se basant sur l'utilisation à grande échelle de Cotesia flavipes contre la pyrale de la canne à sucre au Brésil (Dinardo-Miranda et al., 2014), à un coût maximum de 10-15 €/Ha pour répondre à la recommandation issue d'une analyse de marché réalisée par Bioline AgroScience (France).
Des améliorations des conditions environnementales (température et humidité relative optimales) et du rendement parasitaire ainsi qu'une meilleure gestion des pathogènes (colonies d'élevage exemptes de pathogènes) et de la consanguinité (infusion régulière de spécimens sauvages/de terrain) sont en cours à l'icipe (International Center of Insect Physiology and Ecology) pour atteindre cet objectif. De plus, des études sont conduites pour développer un protocole de stockage des parasitoïdes, afin que la production soit suffisante pendant le pic des commandes.
References:
- Dinardo-Miranda et al. 2014 : https://www.scielo.br/j/brag/a/TQmDyGGvz94FQdyHSV6MMvj/?lang=en
- Giacometti R 1995. Rearing of Sesamia nonagrioides Lefebvre on a meridic diet (Lepidopdera Noctuidae). Redia LXXVIII (1): 19-27.
- Overholt WA, Ochieng JO, Lammers, P, Ogedah K 1994. Rearing and field release methods for Cotesia flavipes Cameron (Hymenoptera: Braconidae), a parasitoid of tropical Gramineous stem borers. International Journal of Tropical Insect Science 15: 253–259.
- Poitou HS, Le Rumeur C, Buès R 1972. Élevage sur milieu artificiel simple de deux Noctuelles parasites du Coton, Earias Insulana et Spodoptera littoralis. Entomologia Experimentalis et Applicata 15: 341-350.
Étude de marché
La sésamie du maïs est présente de façon permanente sur tout le pourtour méditerranéen, notamment en France, Espagne, Portugal, Italie, Grèce, où on estime à environ à 450.000 ha la surface touchée par ce foreur. Le pays le plus touché est la France, avec 300.000 ha concernés (essentiellement sur maïs grain), principalement dans le grand Ouest, la façade Atlantique et la vallée du Rhône. Cependant son aire de répartition s’étend progressivement vers les régions plus septentrionales du fait du changement climatique.
Les dégâts aux maïs sont des pertes directes de rendement, pouvant atteindre en moyenne 11% par forte pression du ravageur, ainsi que des pertes de qualité de la récolte du fait des attaques en fin de cycle du maïs qui augmentent le risque de développement de Fusarium spp. producteurs de mycotoxines.


Actuellement, aucune solution de biocontrôle efficace n’est autorisée pour lutter contre la 2ème génération de ce ravageur, qui est la plus préjudiciable. Les cultures sont protégées essentiellement avec des insecticides chimiques à base de pyréthrinoïdes ou d’anthranilamide. Le coût actuel de cette protection est évalué entre 30 à 45 €/ha suivant les spécialités utilisées (produit plus application), ce qui représente, au prix actuel du maïs, une dépense équivalente à environ 2 quintaux de grains. La protection contre la sésamie peut donc être économiquement viable pour des niveaux de dégâts moyens à élevés.
Par ailleurs, l’utilisation de l’auxiliaire C. typhae, pourra se faire conjointement à des lâchers de trichogrammes (micro Hyménoptère) contre la pyrale du maïs Ostinia nubilalis car ce ravageur est souvent présent avec la sésamie et fore aussi les tiges et épis.